(Trang 21)
Học xong bài học này, em có thể:
• Tiến hành được thí nghiệm để chứng minh: Trong phản ứng hoá học, khối lượng được bảo toàn.
• Phát biểu được định luật bảo toàn khối lượng.
• Nêu được khái niệm phương trình hoá học và các bước lập phương trình hoá học.
• Trình bày được ý nghĩa của phương trình hoá học.
• Lập được sơ đồ phản ứng hoá học dạng chữ và phương trình hoá học (dùng công thức hoá học) của một số phản ứng hoá học cụ thể.
|
Đặt hai cây nến trên đĩa cân, cân ở vị trí thăng bằng. Nếu đốt một cây nến, sau một thời gian, cân có còn thăng bằng không? Giải thích. |
Hình 3.1. Thí nghiệm đốt nến |
I. ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
Để tìm hiểu về định luật bảo toàn khối lượng, tiến hành thí nghiệm sau.
|
Chuẩn bị • Dụng cụ: Cân điện tử, bình tam giác (loại 100 mL), ống hút nhỏ giọt, ống đong. • Hoá chất: Dung dịch sodium sulfate ( Tiến hành Bước 1: Đặt bình tam giác trong đó có chứa 10 mL dung dịch Bước 2: Bóp nút cao su cho dung dịch • Mô tả hiện tượng thí nghiệm, cho biết khối lượng • So sánh |
Hình 3.2. Thí nghiệm dung dịch |
(Trang 22)
Phản ứng hoá học xảy ra ở thí nghiệm 1 có thể được biểu diễn bằng sơ đồ dạng chữ
như sau:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride.
Tổng khối lượng của các chất tham gia phản ứng (barium chloride và sodium sulfate) = Tổng khối lượng của các chất sản phẩm (barium sulfate và sodium chloride).
Định luật bảo toàn khối lượng được hai nhà khoa học Mikhail Vasilyevich Lomonosov (Mi-kha-in Va-si-ly-ích Lô-mô-nô-xốp) – (người Nga, 1711 – 1765) và Antoine Lavoisier (On-toan La-oi-di-ê) – (người Pháp, 1743 – 1794) khám phá độc lập với nhau. Bằng thực nghiệm khác nhau nhưng hai ông đã rút ra một kết luận như nhau.
Định luật bảo toàn khối lượng được phát biểu như sau:
Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng.
* Giải thích: Trong phản ứng hoá học chỉ diễn ra sự thay đổi liên kết giữa các nguyên tử; số nguyên tử của mỗi nguyên tố trước và sau phản ứng không thay đổi, khối lượng nguyên tử không thay dổi. Vì vậy, tổng khối lượng của các chất được bảo toàn.
![]() Thí nghiệm 2
Thí nghiệm 2
Chuẩn bị
• Dụng cụ: Cân điện tử, bình tam giác (loại 100 mL), ống đong.
• Hoá chất: Bột sodium hydrogencarbonate (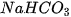 ), dung dịch giấm ăn (
), dung dịch giấm ăn (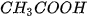 ).
).
Tiến hành
Bước 1: Đặt bình tam giác có chứa 10 mL giấm ăn và một mẩu giấy có chứa một thìa cafe bột 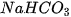 trên đĩa cân điện tử . Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là
trên đĩa cân điện tử . Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là 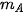 ).
).
Bước 2: Đổ bột 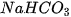 vào bình tam giác, đặt lại mẫu giấy lên đĩa cân, ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là
vào bình tam giác, đặt lại mẫu giấy lên đĩa cân, ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là 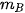 ).
).
• Mô tả hiện tượng thí nghiệm, cho biết khối lượng 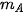 và
và 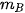 .
.
• So sánh 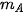 và
và 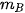 . Giải thích.
. Giải thích.
Phản ứng hoá học xảy ra ở thí nghiệm 2 có thể được biểu diễn bằng sơ đồ dạng chữ
như sau:
Acetic acid + Sodium hydrogencarbonate → Sodium acetate + Carbon dioxide + Nước.
Tổng khối lượng của các chất tham gia phản ứng (acetic acid và sodium hydrogen = Tổng khối lượng của các chất sản phẩm (sodium acetate, carbon dioxide và nước tạo thành).
* Lưu ý: Với các phản ứng hoá học có tạo thành chất khí, khi tính khối lượng của các chất sản phẩm cần lưu ý tính cả khối lượng của chất khí bay ra.
(Trang 23)
|
II. ÁP DỤNG ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG1. Phương trình bảo toàn khối lượngGiả sử có sơ đồ phản ứng hoá học của các chất: A + B → C + D Kí hiệu: Phương trình bảo toàn khối lượng:
2. Áp dụng định luật bảo toàn khối lượngÁp dụng định luật bảo toàn khối lượng để tính khối lượng của các chất trong phản ứng hoá học: Nếu biết khối lượng của (n − 1) chất thì ta tính được khối lượng của chất còn lại (n là tổng số chất phản ứng và chất sản phẩm). Ví dụ Trong phản ứng hoá học ở thí nghiệm 1, biết khối lượng của |
a) Khi đốt cháy hoàn toàn một mẫu gỗ, ta thu được tro có khối lượng nhẹ hơn mẫu gỗ ban đầu. Theo em, sự thay đổi khối lượng này có mâu thuẫn với định luật bảo toàn khối lượng không? b) Đề xuất các bước tiến hành thí nghiệm để kiểm chứng định luật bảo toàn khối lượng trong tình huống trên. |
| Gọi Phương trình bảo toàn khối lượng của các chất trong phản ứng là: ⇒ Thay số vào ta được: Vậy khối lượng của NaCl tạo thành sau phản ứng là 11,7 gam. | Tìm hiểu thêm Tìm hiểu và viết một bài thuyết trình (khoảng 200 từ) về thân thế, sự nghiệp khoa học của hai nhà bác học Mi-kha-in Va-si-ly-ích Lô-mô-nô-xốp và On-toan La-oi-di-ê.
|
(Trang 24)
|
| III. PHƯƠNG TRÌNH HOÁ HỌC1. Phương trình hoá học là gì?Phương trình hoả học là cách thức biểu diễn phản ứng hoá học bằng công thức hoá học của các chất tham gia phản ứng và các chất sản phẩm. Ví dụ: Phản ứng hoá học diễn ra khi cho khí hydrogen tác dụng với khí oxygen tạo thành nước được biểu diễn bằng sơ đồ chữ như sau: Hydrogen +Oxygen → Nước Thay tên các chất bằng công thức hoá học, ta được sơ đồ phản ứng:
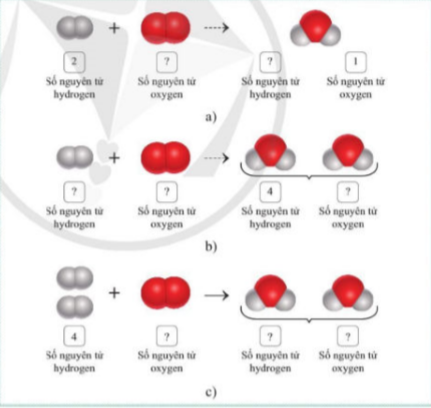
Tìm hệ số thích hợp để điền vào sơ đồ phản ứng sao cho số nguyên tử mỗi nguyên tố đều bằng nhau. Hình 3.3 mô tả quá trình tìm hệ số phù hợp của mỗi chất trong phương trình hoá học.
Hình 3.3. Sơ đồ mô tả quá trình lập phương trình hoá học của phản ứng giữa khí hydrogen và khí oxygen Như vậy, số nguyên tử của mỗi nguyên tố đều đã bằng nhau. Phương trình hóa học của phản ứng được viết như sau:
|
(Trang 25)
2. Các bước lập phương trình hoá học
| Như vậy, từ ví dụ trên việc lập phương trình hoá học có thể được tiến hành theo bốn bước như sau: Bước 1: Viết sơ đồ của phản ứng gồm công thức hoá học của các chất phản ứng và chất sản phẩm.
Bước 2: So sánh số nguyên tử của mỗi nguyên tố có trong phân tử các chất tham gia phản ứng và các chất sản phẩm. Nếu có nguyên tố mà số nguyên tử không bằng nhau thì cần phải cân bằng.
Bước 3: Cân bằng số nguyên tử của mỗi nguyên tố. • Thêm hệ số 2 vào phân tử nước để cân bằng số nguyên tử O.
Số nguyên tử: 2 2 4 2
Số nguyên tử: 4 2 4 2 Bước 4: Kiểm tra và viết phương trình hoá học.
* Lưu ý: Nếu trong các chất phản ứng và các chất sản phẩm có nhóm nguyên tử không thay đổi trước và sau phản ứng (ví dụ nhóm OH, |
|
Ví dụ
Lập phương trình hoá học của phản ứng khi cho dung dịch barium chloride tác dụng với dung dịch sodium sulfate tạo thành barium sulfate không tan và dung dịch sodium chloride.
| Bước 1: Viết sơ đồ phản ứng.
Bước 2: So sánh số nguyên tử/ nhóm nguyên tử của mỗi nguyên tố chất trước và sau phản ứng.
Số nguyên tử/ nhóm nguyên tử: 1 2 2 1 1 1 1 1 Bước 3: Cân bằng số nguyên tử/ nhóm nguyên tử.
Số nguyên tử/ nhóm nguyên tử: 1 2 2 1 1 1 2 2 Bước 4: Kiểm tra và viết phương trình hoá học.
|
-----------------------------------------
(*)↓ : chỉ chất không tan
(Trang 25)
|
a) Cho biết số nguyên tử, số phân tử của các chất phản ứng và các chất sản phẩm. b) Cho biết tỉ lệ hệ số của các chất trong phương trình hoá học. | 3. Ý nghĩa của phương trình hoá họcXét phương trình hoá học: Ta có tỉ lệ chung như sau: Số phân tử Tức là : cứ 2 phân tử Hoặc tỉ lệ theo từng cặp chất: • Cứ 2 phân tử • Cứ 2 phân tử • Cứ 1 phân tử Như vậy, phương trình hoá học cho biết: • Chất tham gia phản ứng và chất sản phẩm. Tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng. Tỉ lệ này bằng đúng tỉ lệ hệ số của mỗi chất trong phương trình hoá học. |
![]() 3. Trong dạ dày người có một lượng hydrochloric acid (HCI) tương đối ổn định, có tác dụng tiêu hoá thức ăn. Nếu lượng acid này tăng lên quá mức cần thiết có thể gây ra đau dạ dày. Thuốc muối có thành phần chính là sodium hydrogencarbonate (
3. Trong dạ dày người có một lượng hydrochloric acid (HCI) tương đối ổn định, có tác dụng tiêu hoá thức ăn. Nếu lượng acid này tăng lên quá mức cần thiết có thể gây ra đau dạ dày. Thuốc muối có thành phần chính là sodium hydrogencarbonate (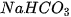 ) giúp giảm bớt lượng acid dư thừa trong dạ dày theo phương trình hoá học:
) giúp giảm bớt lượng acid dư thừa trong dạ dày theo phương trình hoá học:
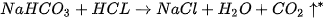
Tìm hiểu và cho biết các thực phẩm có thể gây tăng lượng acid có trong dạ dày.
![]()
• Định luật bảo toàn khối lượng: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng.
• Trong một phản ứng có n chất (bao gồm cả chất tham gia phản ứng và chất sản phẩm), nếu biết khối lượng của (n − 1) chất thì có thể tính được khối lượng của chất còn lại.
• Phương trình hoá học biểu diễn ngắn gọn phản ứng hoá học bằng các kí hiệu và công thức hoá học.
• Các bước lập phương trình hoá học:
Bước 1: Viết sơ đồ phản ứng.
Bước 2: So sánh số nguyên tử của mỗi nguyên tố có trong phân tử của các chất tham gia phản ứng và các chất sản phẩm.
Bước 3: Cân bằng số nguyên tử của mỗi nguyên tố.
Bước 4: Kiểm tra và viết phương trình hoá học.
• Phương trình hoá học cho biết chất tham gia phản ứng, chất sản phẩm và tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất cũng như từng cặp chẩt trong phản ứng.
-----------------------------------
(*)↓ : chỉ chất khí bay lên
 Quan sát hình 3.1:
Quan sát hình 3.1: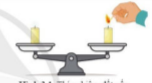
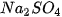 ), dung dịch barium chloride (
), dung dịch barium chloride ( ).
).

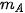 ,
, 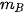 ,
, 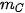 ,
, 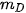 lần lượt là khối lượng của các chất đã tham gia và tạo thành sau phản ứng.
lần lượt là khối lượng của các chất đã tham gia và tạo thành sau phản ứng.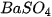 tạo thành là 23,3 gam. Tính khối lượng của NaCl tạo thành.
tạo thành là 23,3 gam. Tính khối lượng của NaCl tạo thành.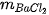 ,
, 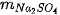 ,
, 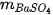 ,
, 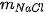 lần lượt là khối lượng của các chất:
lần lượt là khối lượng của các chất: 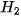 +
+ 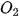 →
→ 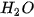
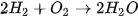
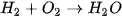
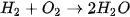
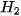 để cân bằng số nguyên tử H.
để cân bằng số nguyên tử H.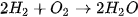
 ,....) thì coi cả nhóm như là một đơn vị để cân bằng.
,....) thì coi cả nhóm như là một đơn vị để cân bằng.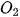 ) tạo thành magnesium oxide (MgO).
) tạo thành magnesium oxide (MgO).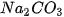 ) tác dụng với dung dịch calcium hydroxide (
) tác dụng với dung dịch calcium hydroxide ( 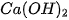 ) tạo thành calcium carbonate (
) tạo thành calcium carbonate (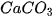 ) không tan (kết tủa) và sodium hydroxide (NaOH).
) không tan (kết tủa) và sodium hydroxide (NaOH).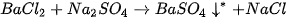
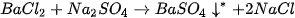
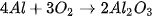
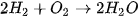
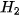 : Số phân tử
: Số phân tử 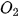 : Số phân tử
: Số phân tử 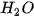 = 2 : 1 : 2.
= 2 : 1 : 2.