(Trang 44)
MỤC TIÊU
- Nêu được khái niệm oxide và phân loại được các oxide theo khả năng phản ứng với acid/base.
- Viết được phương trình hoá học tạo oxide từ kim loại/phi kim với oxygen.
- Tiến hành được thí nghiệm oxide kim loại phản ứng với acid; oxide phi kim phản ứng với base; nêu và giải thích được hiện tượng xảy ra trong thí nghiệm và rút ra nhận xét về tính chất hoá học của oxide.
Tại sao vôi sống (CaO) lại được sử dụng để khử chua đất trồng trọt?
I – Khái niệm
Tìm hiểu về khái niệm oxide
Bảng 10.1. Tên, công thức hoá học của một số oxide
| Tên oxide (1) | Công thức hoá học (2) | Tên oxide (3) | Công thức hoá học (4) |
| Barium oxide | BaO | Carbon dioxide |  |
| Zinc oxide | ZnO | Sulfur trioxide | 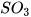 |
| Aluminium oxide | 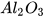 | Diphosphorus pentoxide | 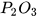 |
Nhận xét thành phần nguyên tố trong công thức phân tử của các oxide ở cột (2), (4) và thực hiện các yêu cầu:
1. Đề xuất khái niệm về oxide.
2. Phân loại oxide.
Oxide là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxygen.
Dựa vào thành phần nguyên tố, oxide có thể phân thành hai loại: oxide kim loại và oxide phi kim.
Oxide kim loại có thể được tạo thành từ phản ứng của kim loại với oxygen.
Ví dụ: 2Ba + 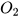 → 2BaO
→ 2BaO
Oxide phi kim có thể được tạo thành từ phản ứng của phi kim với oxygen.
Ví dụ: C+ 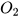 →
→ 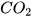
Dựa vào tính chất hoá học, oxide có thể phân thành bốn loại: oxide acid, oxide base, oxide lưỡng tính và oxide trung tính.
Quy tắc gọi tên oxide:
- Với nguyên tố chỉ có một hoá trị: tên nguyên tố + oxide.
Ví dụ: zinc oxide, ZnO.
(Trang 45)
- Với nguyên tố nhiều hoá trị: Tên nguyên tố (hoá trị của nguyên tố) + oxide
- Với oxide của phi kim nhiều hoá trị có thể gọi theo cách sau:
(Tiền tố chỉ số nguyên tử của nguyên tố) Tên nguyên tố + (tiền tố chỉ số nguyên tử oxygen) oxide
(Tiền tố mono là một, di là hai, tri là ba, tetra là bốn...)
Ví dụ: 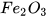 đọc là iron(III) oxide;
đọc là iron(III) oxide;
CO đọc là carbon monoxide hoặc carbon(II) oxide;
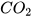 đọc là carbon dioxide hoặc carbon(IV) oxide;
đọc là carbon dioxide hoặc carbon(IV) oxide;
Cho các sơ đồ phản ứng sau:
(1)..?.. + 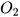 ---->
----> 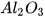 (2) P+..?..---->
(2) P+..?..---->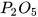
(3) S+..? ---->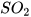 (4) Mg +
(4) Mg + 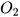 ---->..?..
---->..?..
Hoàn thành các phương trình hoá học và đọc tên các sản phẩm tạo thành.
II – Tính chất hoá học
1. Oxide acid
Tìm hiểu tính chất hoá học của oxide acid
Chuẩn bị: dung dịch hydrochloric acid HCl 0,1 M, thìa lấy hoá chất, ống thuỷ tinh hình chữ L, nút cao su, ống nghiệm (1) dựng khoảng 1 gam đá vôi (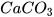 ) đã đập nhỏ, ống nghiệm (2) đựng nước vôi trong (
) đã đập nhỏ, ống nghiệm (2) đựng nước vôi trong (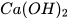 ).
).
Tiến hành:
Cho vào ống nghiệm (1) khoảng 3 mL dung dịch hydrochloric acid 0,1 M để điều chế khí carbon dioxide, đậy ống nghiệm bằng nút cao su có ống thuỷ tinh hình chữ L xuyên qua. Dẫn khí carbon dioxide vào ống nghiệm (2). Quan sát.
Thực hiện các yêu cầu:
Nêu hiện tượng xảy ra khi mới dẫn khí carbon dioxide vào nước vôi trong và khi dẫn khí carbon dioxide vào nước vôi trong một khoảng thời gian.
Các oxide acid khác như 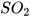 ,
, 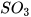 ,
, 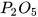 ,... cũng phản ứng với dung dịch base tạo thành muối và nước.
,... cũng phản ứng với dung dịch base tạo thành muối và nước.
Oxide acid khi tác dụng với dung dịch base tạo thành muối và nước.
Ví dụ: carbon dioxide tác dụng với dung dịch calcium hydroxide.
Khi sục từ từ khí carbon dioxide vào dung dịch calcium hydroxide, ban đầu dung dịch vẫn đục do tạo muối calcium carbonate không tan:
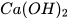 +
+ 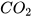 →
→ 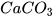 +
+ 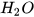
(Trang 46)
Viết phương trình hoá học của phản ứng giữa 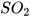 và dung dịch NaOH minh hoạ cho tính chất hoá học của sulfur dioxide.
và dung dịch NaOH minh hoạ cho tính chất hoá học của sulfur dioxide.
1. Carbon dioxide còn được gọi là khí nhà kính, chiếm khoảng 0,041% thể tích khí quyển. Khí carbon dioxide được tạo ra từ nhiều nguồn khác nhau như: trong khói bụi từ núi lửa phun trào, khí thải công nghiệp, hoạt động giao thông trong quá trình đốt nhiên liệu để chạy động cơ ô tô, xe máy,... Việc gia tăng lượng carbon dioxide trong không khí là nguyên nhân chính làm Trái Đất nóng lên.
2. Khí thải của các nhà máy nếu không được xử lí theo đúng quy định trước khi đi vào môi trường có thể chứa một lượng tương đối lớn các oxide như sulfur dioxide và nitrogen dioxide. Các khí này có trong không khí là nguyên nhân gây ra mưa acid.
2. Oxide base
Tìm hiểu tính chất hoá học của oxide base
Chuẩn bị: CuO (bột); dung dịch 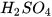 loãng; thìa lấy hoá chất, ống nghiệm.
loãng; thìa lấy hoá chất, ống nghiệm.
Tiến hành:
Cho vào ống nghiệm 1 thìa nhỏ bột CuO, thêm khoảng 3 mL dung dịch H,SO, lắc đều ống nghiệm và quan sát.
Thực hiện yêu cầu:
Nêu hiện tượng của thí nghiệm trên và giải thích.
Các oxide base khác như 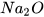 , CaO,
, CaO, 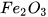 ... cũng phản ứng với dung dịch acid tạo thành muối và nước.
... cũng phản ứng với dung dịch acid tạo thành muối và nước.
Oxide base tác dụng với dung dịch acid tạo thành muối và nước.
Ví dụ: phản ứng loại bỏ gỉ sắt.
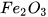 + 6HCl ------->
+ 6HCl -------> 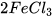 +
+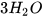
3. Oxide lưỡng tính
Oxide lưỡng tính tác dụng được với cả dung dịch acid, dung dịch base tạo thành muối và nước. Một số oxide lưỡng tính thường gặp như: 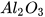 , ZnO,...
, ZnO,...
4. Oxide trung tính
Ngoài ra, còn có một số oxide không tác dụng với dung dịch acid và dung dịch base, chúng được gọi là oxide trung tính hay oxide không tạo muối. Ví dụ: CO, NO,...
(Trang 47)
1. Viết phương trình hoá học minh hoạ cho tính chất hoá học của oxide base và oxide acid. Lấy magnesium oxide và sulfur dioxide làm ví dụ.
2. Cho các oxide sau: CaO, 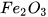 ,
, 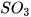 ,
, 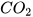 , CO.
, CO.
Oxide nào có thể tác dụng với:
a) Dung dịch HCl
b) Dung dịch NaOH.
Viết các phương trình hoá học. Hãy cho biết các oxide trên thuộc loại oxide nào?
EM ĐÃ HỌC
- Oxide là hợp chất hoá học gồm hai nguyên tố, trong đó có một nguyên tố là oxygen.
- Các oxide được chia làm bốn loại: oxide base; oxide acid; oxide lưỡng tính; oxide trung tính.
Oxide acid tác dụng với dung dịch kiềm tạo thành muối và nước.
Oxide base tác dụng với dung dịch acid tạo thành muối và nước.
Oxide lưỡng tính vừa tác dụng được với dung dịch acid, vừa tác dụng được với dung dịch base tạo thành muối và nước.
Oxide trung tính không tác dụng với dung dịch acid, dung dịch base.
EM CÓ THỂ
- Dựa vào tính chất của oxide để giải thích các hiện tượng hoá học trong thực tiễn đời sống như: hố vôi tôi nổi váng trắng.
- Giải thích được việc dùng vôi bột để khử chua đất trồng,...