(Trang 28)
MỤC TIÊU
- Tính được lượng chất trong phương trình hoá học theo số mol, khối lượng hoặc thể tích ở điều kiện 1 bar và 25 °C.
- Nêu được khái niệm hiệu suất của phản ứng.
- Tính được hiệu suất của một phản ứng dựa vào lượng sản phẩm thu được theo lí thuyết và lượng sản phẩm thu được theo thực tế.
Bằng cách nào có thể tính được lượng chất tham gia và lượng chất sản phẩm trong quá trình sản xuất?
I - Tính lượng chất trong phương trình hoá học
1. Tính lượng chất tham gia trong phản ứng
Ví dụ: Khi cho Fe tác dụng với dung dịch HCl thì xảy ra phản ứng hoá học sau:
Fe + 2HCl ------> 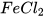 +
+ 
Cần dùng bao nhiêu mol Fe để thu được 1,5 mol  ?
?
Hướng dẫn giải:
Theo phương trình hoá học:
1 mol Fe tham gia phản ứng sẽ thu được 1 mol  .
.
Vậy: 1,5 mol Fe ........................ 1, 5 mol  .
.
Số mol Fe cần dùng để thu được 1,5 mol  là 1,5 mol.
là 1,5 mol.
2. Tính lượng chất sinh ra trong phản ứng
Ví dụ: Hoà tan hết 0,65 gam Zn trong dung dịch HCl 1 M, phản ứng xảy ra như sau:
Zn + 2HCI -----> 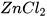 +
+ 
Tính khối lượng muối zinc chloride (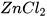 ) tạo thành sau phản ứng.
) tạo thành sau phản ứng.
Hướng dẫn giải:
- Tính số mol Zn tham gia phản ứng: 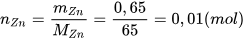 .
.
- Tìm số mol muối zinc chloride tạo thành sau phản ứng dựa theo tỉ lệ số mol các chất trong phương trình hoá học.
Theo phương trình hoá học:
1 mol Zn tham gia phản ứng sẽ thu được 1 mol 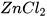 .
.
Vậy: 0,01 mol Zn ............................ 0,01 mol 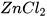 .
.
(Trang 29)
- Tính khối lượng zinc chloride tạo thành sau phản ứng:
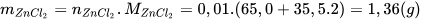
1. Tính thể tích khí hydrogen thu được trong ví dụ trên ở 25 °C, 1 bar.
2. Khi cho Mg tác dụng với dung dịch 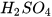 loãng thì xảy ra phản ứng hoá học như sau:
loãng thì xảy ra phản ứng hoá học như sau:
Mg + 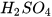 -------->
-------->  + H2
+ H2
Sau phản ứng thu được 0,02 mol  . Tính thể tích khí
. Tính thể tích khí 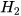 thu được ở 25 °C, 1 bar.
thu được ở 25 °C, 1 bar.
II – Hiệu suất phản ứng
1. Khái niệm hiệu suất phản ứng
Xét phản ứng xảy ra khi đốt cháy 1 mol carbon:
Theo phương trình hoá học:
C+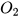 ------->
-------> 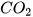
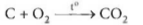
Nếu 1 mol C cháy hết, thu được 1 mol 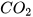 thì hiệu suất phản ứng đạt 100% (phản ứng xảy ra hoàn toàn). Tuy nhiên, trong thực tế số mol
thì hiệu suất phản ứng đạt 100% (phản ứng xảy ra hoàn toàn). Tuy nhiên, trong thực tế số mol 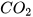 thu được thường nhỏ hơn 1 mol.
thu được thường nhỏ hơn 1 mol.
Xét phản ứng trong trường hợp tổng quát:
Chất phản ứng --------> Sản phẩm
Với hiệu suất phản ứng nhỏ hơn 100%, khi đó:
- Lượng chất phản ứng dùng trên thực tế sẽ lớn hơn lượng tính theo phương trình hoá học (theo lí thuyết).
- Lượng sản phẩm thu được trên thực tế sẽ nhỏ hơn lượng tính theo phương trình hoá học.
Khi nung nóng 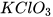 xảy ra phản ứng hoá học sau (phản ứng nhiệt phân):
xảy ra phản ứng hoá học sau (phản ứng nhiệt phân):
2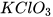 -------> 2KCl + 3
-------> 2KCl + 3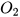 .
.
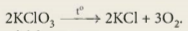
Biết rằng hiệu suất phản ứng nhỏ hơn 100%.
Hãy chọn các từ/cụm từ (lớn hơn, nhỏ hơn, bằng) phù hợp với nội dung còn thiếu trong các câu sau đây:
- Khi nhiệt phân 1 mol 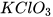 thì thu được số mol
thì thu được số mol 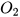 ...(1)... 1,5 mol.
...(1)... 1,5 mol.
- Để thu được 0,3 mol 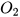 thì cần số mol
thì cần số mol 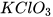 ...(2)... 0,2 mol.
...(2)... 0,2 mol.
2. Tính hiệu suất phản ứng
Xét phản ứng trong trường hợp tổng quát: Chất phản ứng ----> Sản phẩm.
Theo lí thuyết, phản ứng trên thu được m gam một chất sản phẩm. Nhưng thực tế thu được m' gam chất đó (m' ≤ m).
Hiệu suất phản ứng được tính theo công thức: H= 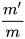 .100 (%).
.100 (%).
(Trang 30)
Nếu lượng chất tính theo số mol thì hiệu suất được tính theo công thức: H=  .100(%).
.100(%).
Trong đó: n là số mol chất sản phẩm tính theo lí thuyết, n là số mol chất sản phẩm thu được theo thực tế.
Ví dụ: Cho 8 gam iron(III) oxide tác dụng với khí hydrogen dư ở nhiệt độ cao, thu được 4,2 gam iron.
Phản ứng xảy ra như sau: 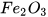 + 3
+ 3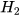 --------> 2Fe + 3
--------> 2Fe + 3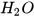 .
.
Tính hiệu suất phản ứng.
Hướng dẫn giải:
Bước 1: Tính lượng Fe thu được theo lí thuyết.
Số mol 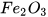 :
: 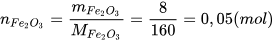
Theo phương trình hoá học: 1 mol 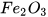 tham gia phản ứng sẽ thu được 2 mol Fe.
tham gia phản ứng sẽ thu được 2 mol Fe.
Vậy: 0,05 mol 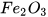 . ......... 0,1 mol Fe.
. ......... 0,1 mol Fe.
Khối lượng Fe thu được theo lí thuyết: 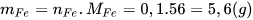 .
.
Bước 2: Tính hiệu suất phản ứng.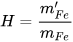 . 100 (%)=
. 100 (%)=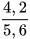 . 100 (%) = 75(%).
. 100 (%) = 75(%).
Chú ý: Cũng có thể tính hiệu suất từ số mol chất sản phẩm theo lí thuyết và thực tế.
Trong ví dụ trên, ta có:
Số mol Fe thực tế: 
Hiệu suất phản ứng: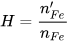 . 100 (%)=
. 100 (%)= . 100 (%) = 75(%).
. 100 (%) = 75(%).
Nung 10 gam calcium carbonate (thành phần chính của đá vôi), thu được khí carbon dioxide và m gam vôi sống. Giải thiết hiệu suất phản ứng là 80%, sống. Giả thiết hiệu xác định m.
| EM ĐÃ HỌC | EM CÓ THỂ |
(m,n lần lượt là khối lượng và số mol chất sản phẩm tính theo lí thuyết; m', n' lần lượt là khối lượng và số mol chất sản phẩm tính theo thực tế). | Đánh giá được phản ứng hoá học xảy ra hoàn toàn hay không hoàn toàn. |
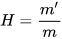 . 100 (%)=
. 100 (%)= . 100 (%)
. 100 (%)