Hiểu bản chất, điều kiện xáy ra phán ứng trao đối ion trong dung dịch các chất điện li và viết được phương trình ion rút gọn của phản ứng.
I - ĐIỀU KIỆN XẢY RA PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI
1. Phản ứng tạo thành chất kết tủa
Thí nghiệm. Nhỏ dung dịch natri sunfat (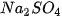 ) vào ống nghiệm đựng dung dịch bari clorua (
) vào ống nghiệm đựng dung dịch bari clorua (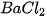 ) thấy kết tủa trắng của BaSO, xuất hiện :
) thấy kết tủa trắng của BaSO, xuất hiện :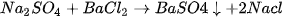 (1)
(1)
Giải thích: 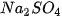 và
và 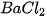 ; đều dễ tan và phân li mạnh trong nước :
; đều dễ tan và phân li mạnh trong nước :
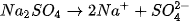
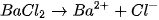
Trong số bốn ion được phân lï ra chỉ có các ion 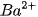 và
và 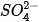 kết hợp được với nhau tạo thành chất kết tủa là
kết hợp được với nhau tạo thành chất kết tủa là 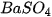 (hình 1.3), nên thực chất phản ứng
(hình 1.3), nên thực chất phản ứng
trong dung dịch là :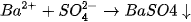

Phương trình (2) được gọi là phương trình ion rút gọn của phản ứng (1).
Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Cách chuyển phương trình dưới dạng phân tử thành phương trình ion rút gọn như sau :
- Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử. Phương trình thu được gọi là phương trình Ion đầy đủ, thí dụ, đối với phản ứng (1) ta có :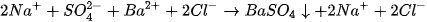
- Lược bỏ những ion không tham gia phản ứng, ta được phương trình Ion rút gọn :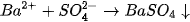
Từ phương trình này ta thấy rằng, muốn điều chế kết tủa 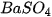 , cần trộn hai dung dịch, một dung dịch chứa ion
, cần trộn hai dung dịch, một dung dịch chứa ion 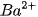 , dung dịch kia chứa ion
, dung dịch kia chứa ion 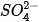
2. Phản ứng tạo thành chất điện li yếu
a) Phản ứng tạo thành nước
Thí nghiệm. Nhỏ vài giọt dung dịch phenolphtalein vào cốc đựng dung dịch NaOH 0,10M, dung dịch
có màu hồng (hình 1.4).

Rót từ từ dung dịch HC] 0,10M vào cốc trên, vừa rót vừa khuấy, cho đến khi mất màu. Phản ứng như sau :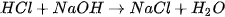
Giải thích: NaOH và HCI đều dễ tan và phân li mạnh trong nước: 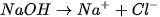
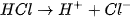
Các ion 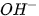 trong dung dịch làm cho phenolphtalein chuyển sang màu hồng. Khi cho dung dịch HCl vào, các ion
trong dung dịch làm cho phenolphtalein chuyển sang màu hồng. Khi cho dung dịch HCl vào, các ion 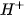 của HCI sẽ phản ứng với các ion
của HCI sẽ phản ứng với các ion 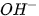 của NaOH tạo thành chất điện li rất yếu là
của NaOH tạo thành chất điện li rất yếu là 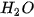 . Phương trình ion rút gọn :
. Phương trình ion rút gọn :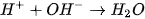
Khi màu của dung dịch trong cốc mất, đó là lúc các ion 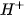 của HCI đã phản ứng hết với các ion
của HCI đã phản ứng hết với các ion 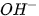 của NaOH.
của NaOH.
Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ xảy ra vì tạo thành chất điện li rất yếu là 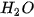 . Chẳng hạn,
. Chẳng hạn, 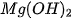 ít tan trong nước, nhưng dễ dàng tan trong dung dịch axit mạnh :
ít tan trong nước, nhưng dễ dàng tan trong dung dịch axit mạnh :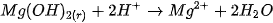
Phản ứng tạo thành axit yếu
Thí nghiệm. Nhỏ dung dịch HCI vào ống nghiệm đựng dung dịch 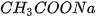 ,
,
axit yếu CHCOOH sẽ tạo thành :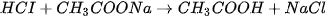
Giải thích. HCl và 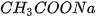 là các chất dễ tan và phân lí mạnh :
là các chất dễ tan và phân lí mạnh :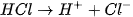
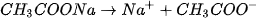
Trong dung dịch, các ion 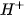 sẽ kết hợp với các ion
sẽ kết hợp với các ion 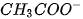 tạo thành chất điện li yếu là
tạo thành chất điện li yếu là 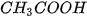 (mùi giấm). Phương trình Ion rút gọn :
(mùi giấm). Phương trình Ion rút gọn :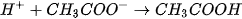
Phản ứng tạo thành chất khí
Thí nghiệm. Rót dung dịch HCI vào cốc đựng dung dịch 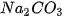 ta thấy có bọt khí thoát ra :
ta thấy có bọt khí thoát ra :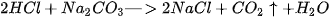
Giải thích. HCI và 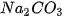 đều dễ tan và phân li mạnh :
đều dễ tan và phân li mạnh :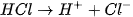
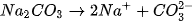
Các ion 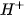 và
và 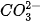 trong dung dịch kết hợp với nhau tạo thành axit yếu là
trong dung dịch kết hợp với nhau tạo thành axit yếu là 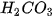 axit này không bền bị phân huỷ ra
axit này không bền bị phân huỷ ra 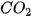 và
và 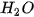 .
.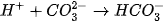
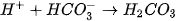
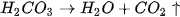
Phương trình ion rút gọn: 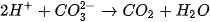
Phản ứng giữa muối cacbonat và dung dịch axit rất dễ xảy ra vì vừa tạo thành chất điện li rất yếu là 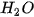 , vừa tạo ra chất khí
, vừa tạo ra chất khí 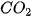 tách khỏi môi trường phản ứng. Chẳng hạn, các muối cacbonat ít tan trong nước nhưng tan dễ dàng trong
tách khỏi môi trường phản ứng. Chẳng hạn, các muối cacbonat ít tan trong nước nhưng tan dễ dàng trong
các dung dịch axit. Thí dụ, đá vôi (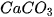 ) tan rất dễ trong dung dịch HCI
) tan rất dễ trong dung dịch HCI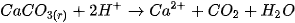

II - KẾT LUẬN
Phản ứng xảy ra trong dung dịch các chất điện lï là phản ứng giữa các ion.
Phản ứng trao đối ion trong dung dịch các chất điện l¡ chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau :
- chất kết tủa.
- Chất điện lï yếm.
- Chất khí.
BÀI TẬP
1. Điều kiện để xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li là gì ? Lấy các thí dụ minh hoa.
2. Tại sao các phản ứng giữa dung dịch axit và hiđroxit có tính bazơ và phản ứng giữa muối cacbonat và dung dịch axit rất dễ xảy ra ?
3. Lấy một số thí dụ chứng minh rằng : bản chất của phản ứng trong dung dịch các chất điện li là phản ứng giữa các ion.
4. Phương trình ion rút gọn của phản ứng cho biết :
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
5. Viết các phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch giữa các cặp chất sau :
a) 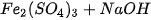
b) 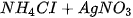
c) NaF + HCI
d) 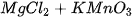
e) FeS (r) + HCI
g) HCIO + KOH
6. Phản ứng nào dưới đây xảy ra trong dung dịch tạo được kết tủa 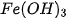 (hình 1.6) ?
(hình 1.6) ?
A. 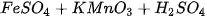
B. 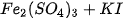
C. 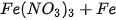
D. 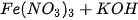

7. Lấy thí dụ và viết các phương trình hoá học dưới dạng phân tử và ion rút gọn cho các phản ứng sau :
a) Tạo thành chất kết tủa.
b) Tạo thành chất điện li yếu.
c) Tạo thành chất khí.